| Noutăţi [231] |
| Atestare [5] |
| Perfecţionare [191] |
| Anunţuri [22] |
- 2008 Noiembrie
- 2008 Decembrie
- 2009 Ianuarie
- 2009 Februarie
- 2009 Aprilie
- 2009 Mai
- 2009 Iunie
- 2009 Iulie
- 2009 August
- 2009 Septembrie
- 2009 Octombrie
- 2009 Noiembrie
- 2009 Decembrie
- 2010 Ianuarie
- 2010 Februarie
- 2010 Martie
- 2010 Aprilie
- 2010 Mai
- 2010 Iunie
- 2010 Iulie
- 2010 August
- 2010 Septembrie
- 2010 Octombrie
- 2010 Noiembrie
- 2010 Decembrie
- 2011 Ianuarie
- 2011 Februarie
- 2011 Martie
- 2011 Aprilie
- 2011 Mai
- 2011 Iunie
- 2011 Iulie
- 2011 August
- 2011 Septembrie
- 2011 Octombrie
- 2011 Noiembrie
- 2011 Decembrie
- 2012 Ianuarie
- 2012 Februarie
- 2012 Martie
- 2012 Aprilie
- 2012 Iunie
- 2012 Noiembrie
- 2012 Decembrie
- 2013 Ianuarie
- 2013 Februarie
- 2013 Aprilie
- 2013 Iunie
- 2013 Iulie
- 2013 Decembrie
- 2014 Ianuarie
- 2014 Februarie
- 2014 Martie
- 2014 Septembrie
- 2017 Ianuarie
17:22 ТРАКТОГРАФИЯ ГОЛОВНОГО МОЗГА: МЕТОД ВИЗУАЛИЗАЦИИ ПРОВОДЯЩИХ ПУТЕЙ НА ОСНОВЕ ДИФФУЗИ0ННО-ВЗВЕШЕНН0Й МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ | |
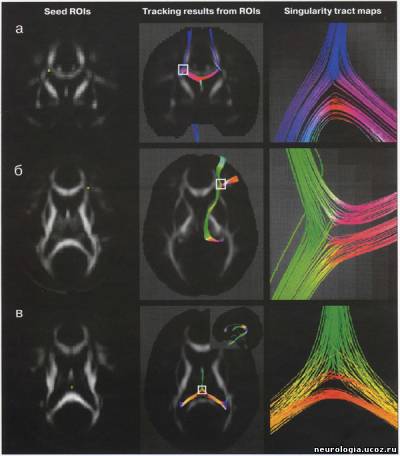
| Трактография головного мозга - диагностический метод, основанный на диффузионно-взвешенной магнитно-резонансной томографии (ДВ МРТ), позволяющий визуализировать ориентацию и целостность проводящих путей головного мозга in vivo [1 -5]. Области клинического применения этого метода в настоящее время уточняются. ДВ МРТ - техника получения изображений головного мозга, основанная на измерении диффузии воды в каждом объемном элементе (вокселе) изображения. На его основании формируется диффузионная матрица [1], из которой можно получить 3 числовых значения и 3 вектора, описывающих силу и направление диффузии воды в выбранной точке. Вода диффундирует быстрее вдоль волокон проводящих путей белого вещества, поскольку мембраны аксонов выступают препятствием для ее диффузии в других направлениях. При патологических процессах, например, при ишемии, воспалении, нейродегенеративных заболеваниях, травме, происходит нарушение линейной организации проводящих путей [6, 7]. ДВ МРТ улавливает эту перемену направления диффузии, создавая изображения, позволяющие изучить изменения микроструктуры проводящих путей мозга in vivo. Большинство работ, исследующих микроструктуру белого вещества головного мозга при помощи ДВ МРТ, основано на построении двухмерных серошкальных карт с использованием показателей величины диффузии в каждом вокселе. Трактография - дополнение к стандартным методам ДВ МРТ, позволяющее получить более детальную информацию об ориентации и кривизне (угле наклона) проводящих путей белого вещества при прохождении через весь головной мозг. При этом для построения траектории диффузии воды по волокнам проводящих путей используется как матрица числовых значений, так и векторы диффузии воды. Траектории изображаются графически в виде пучка кривых [8-11]. Кроме того, есть методы, позволяющие на основе диффузионной информации построить карты, в которых цветом обозначена ориентация волокон белого вещества [12]. Как правило, при его повреждении повышается диффузия и изменяется направление движения молекул воды. Считается, что по таким изменениям диффузии можно выявить поражение аксонов, а также оценить выраженность демиелинизации, глиоза или других патологических процессов [6, 13]. Трактографию проводят на МР-томографах с силой поля 1,5-3 Тл. Это выглядит так: используется многоканальная (не менее 6 каналов) фазированная поверхностная катушка для головного мозга. Для ДВ МРТ применяют спин-эхо и эхо-планарную последовательность(single-shot spin-echo echo-planar imaging). Для коррекции двигательных артефактов используют эхо-навигатор. Применяется методика параллельной томографии (например, SENSE) с фактором 2-4. Количество срезов - 96. Они ориентированы перпендикулярно линии, соединяющей переднюю и заднюю спайки мозга. Толщина среза - 2,3 мм, промежуток между ними - 0, поле изображения - 220 мм, время повторения (TR) - 6,599-8,280 мс, время эхо (ТЕ) - 70 мс, количество у среднений - 2, коэффициент диффузии (Ь) - 600 с/мм2. Время исследования - около 9 минут. Реконструкцию трактограмм проводят с использованием специального программного обеспечения [14]. После получения МР-изображений исследователь, знакомый с анатомией и физиологией головного мозга, выделяет область интереса, в которой будет проводиться реконструкция трактограмм (например, кортикоспинальный тракт на аксиальных изображениях, мозолистое тело на сагиттальных) [3]. В результате получаются векторные карты, в которых направление диффузии кодируется цветом: чаще всего красным обозначается движение воды «вправо-влево» (х-элементы), зеленым - «вперед-назад» (у-элементы), синим - «вверх-вниз» (z-элементы). На их основе создаются трех-мерные изображения трактов (рис. 1). Рис. 1. Трактограммы мозга здорового добровольца а — область пересечения волокон мозолистого тела и путей, идущих к переднему бедру внутренней и наружной капсул; б - таламокортикальные и кортикоталамические соединения префронтальной коры; в —разделение свода мозолистого тела на волокна, идущие к правой и левой височной доле В каждом случае область интереса (ROI) обозначена желтой точкой на изображениях в левом столбце. В среднем изображены проекции трактограмм на области мозга. В правом столбце приведены увеличенные изображения фрагментов проводящих путей [58] Его значение и точное место в клинической медицине еще предстоит изучить. В настоящее время трактографию пробуют применять в диагностике аксонал ьных повреждений при хронической ишемии головного мозга и при болезнях мотонейрона [15], при рассеянном склерозе [16, 17] и остром диссеминированном энцефаломиелите [18], опухолях головного мозга и аномалиях развития ЦНС [2,19], кортикальных инфарктах [20]. Е. Kieretal. (2004) для уточнения топографии прохождения проводящих путей в белом веществе головного мозга предложили сочетать трактографию с обычным анатомическим исследованием мозга [21]. На основании метода трактографии были составлены атласы анатомии проводящих путей белого вещества головного мозга [12], причем с его помощью их данные были уточнены (рис. 2). Так, были получены доказательства существования теменно-височных соединений [22]. Возможно исследование in vivo проводящих путей мозга человека и подопытных животных, сравнение их между собой [23]. Интересное направление исследований - осуществление комбинации функциональной МРТ (фМРТ), диагностирующей изменения кровотока и оксигенации головного мозга, с трактографией, поскольку при этом возможна одновременная визуализация активированных областей головного мозга и идущих от них в другие области проводящих путей [24]. 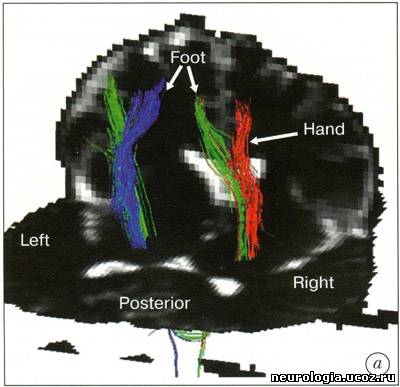 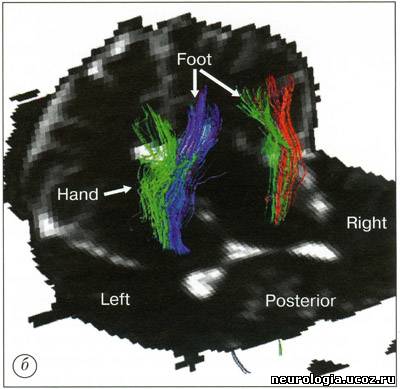 Рис. 2. Правая (а) и левая (б) задняя косая проекция ортикоспинального тракта (CST) у 40-летнего здорового добровольца а — волокна CST к рукам обозначены красным, к ногам - зеленым цветом; б — волокна CST к рукам обозначены зеленым, к ногам - синим цветом [52] Трактографию применяют для изучения развития белого вещества головного мозга. Известно, что к моменту рождения ребенка сформированы почти все нейроны. Однако в течение нескольких лет после рождения мозг продолжает развиваться. Большое значение для его развития имеет процесс миелинизации, во время которого наблюдается формирование миелиновой оболочки аксонов. Миелин играет роль изолирующей мембраны и обеспечивает проведение нервных импульсов в 10-100 раз быстрее, чем в немиелинизированных или маломиелинизированных при рождении ребенка волокнах. Развитие миелина - одна из характеристик зрелости нервной системы. В работе J. Volpe (1995) было показано, что у детей первыми миелинизируются первичные сенсорные (зрение, слух, тактильные ощущения) и моторные области [25]. ДВ МРТ потенциально может характеризовать степень зрелости головного мозга новорожденных. Миелинизированные волокна обладают более упорядоченной диффузией, чем немиелинизированные - этот показатель зависит от стадии развития. ДВ МРТ мозга новорожденного обладает рядом особенностей: • проводящие пути сформированы не до конца, диффузия в них имеет менее направленный характер, что затрудняет их реконструкцию; • исследование новорожденных проводится под наркозом, поскольку без него наблюдаются выраженные артефакты от движения; • меньше соотношение сигнал/шум. Размеры мозга меньше, чем у взрослого, следовательно величина воксела также меньше, поэтому сигнал снижен. Первые годы жизни - критическое время для развития головного мозга. Чем раньше поставлен диагноз его возможного повреждения, тем выше шансы успешного лечения. К примеру, ДВ МРТ можно использовать для диагностики повреждения головного мозга в результате гипоксии в родах или лекарственного воздействия, возникших при нарушении кровотока. Кроме того, ДВ МРТ и трактография дают дополнительную информацию о развитии головного мозга. ДВ МРТ может быть полезна при диагностике многочисленных заболеваний белого вещества головного мозга. Например, при травме, нарушениях мозгового кровообращения, опухолях головного мозга, фокальной эпилепсии, рассеянном склерозе, туберозном склерозе, болезнях Паркинсона и Альцгеймера, ВИЧ-инфекции, болезни Краббе, церебральной адренолейкодистрофии, алкогольной или гипертонической энцефалопатии, митохондриальных энцефаломиопатиях и некоторых других заболеваниях [19, 26-34] (рис. 3, 4). При опухолях головного мозга трактография позволяет определить повреждение и смещение проводящих путей белого вещества. U. Wieshmann et al. (2000) представили доказательства смещения волокон проводящих путей лучистого венца у больного с низкодифференцированной глиомой по сравнению с данными трактографии лучистого венца 20 здоровых испытуемых [35]. S. Mori et al. (2002) описали смещение и деструкцию верхнего продольного пучка и лучистого венца у 2 больных санапластической астроцитомой [36]. С. Gossl et al. (2002) наблюдали перекос пирамидного пути у больного с высоко-дифференцированной глиомой [37]. B.Witweret al. (2002) описали отек области проводящих путей [38]. S. Zhang et al. (2004) анализировали асимметрию проводящих путей белого вещества между здоровым и пораженным опухолью полушарием головного мозга [39]. 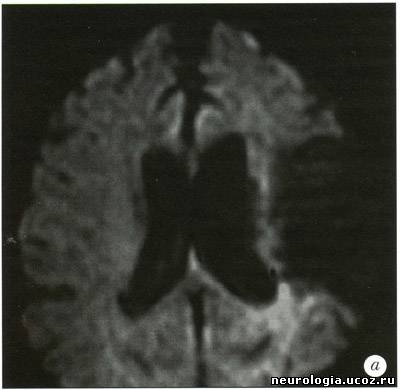 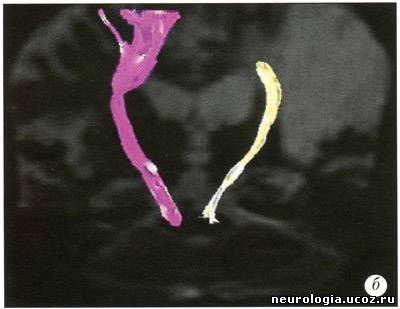 Рис. 3. Диагностические возможности трак-тографии при ишемическом нарушении мозгового кровообращения: а) постинсультная киста в зоне кровоснабжения средней мозговой артерии; б) полный перерыв кортикоспинального тракта на уровне очага Оставшиеся волокна тракта имеют меньший объем, чем в здоровом полушарии [59] Опухоли и отек вокруг них - частая причина значительных изменений в волокнах прилежащих к ним проводящих путей. ДВ МРТ и трактография могут использоваться при изучении роста опухоли и планировании оперативного вмешательства. При проведении ДВ МРТ у пациентов с рассеянным склерозом выявляется повышение диффузии в очагах демиелинизации головного мозга [17]. Причем в более активных очагах наблюдается более выраженное увеличение диффузии. Изучение взаимосвязи между очагами демиелинизации и поврежденными проводящими путями может помочь в понимании механизмов аксонального повреждения. Некоторые волокна проводящих путей обрываются в очагах демиелинизации, некоторые продолжают свой ход дальше. По данным J. Simon et al. (2005), поврежденные пути можно идентифицировать на ранних стадиях заболевания, когда диагноз рассеянного склероза еще не поставлен [40]. Очаги демиелинизации часто рассеяны по головному мозгу и имеют разную степень активности. Визуализация поврежденных проводящих путей при помощи трактографии поможет в оценке активности очагов. Идентификация областей серого вещества, с которым соединяются поврежденные проводящие пути, объяснит клинические проявления рассеянного склероза. В настоящее время идет его активное изучение при помощи ДВ МРТ и трактографии, поскольку эти методики помогают в понимании заболевания и планировании дальнейших исследований. Белое вещество головного мозга также может поражаться при ВИЧ-инфекции [41]. В то же время при относительно неагрессивном течении и при наличии когнитивных нарушений трудно выявить структурные изменения белого вещества [42]. В такой ситуации ДВ МРТ становится методикой, более чувствительной к выявлению поражения белого вещества головного мозга, чем обычная МРТ [31, 43, 44]. Однако с 50-60-х годов прошлого века появились работы, доказывающие, что КСТ проходит в третьей четверти заднего бедра внутренней капсулы [48-51]. Эти данные были подтверждены при проведении ДВ МРТ с использованием трактографии [52]. Несмотря на это, позднее было опубликовано, по меньшей мере, два анатомических исследования, доказывающих прохождение цефалической части КСТ в средней трети заднего бедра внутренней капсулы и более каудальной порции - в ее задней трети [53, 54]. Отличие результатов анатомических и МРТ исследований связано с тем, что ориентация срезов при этих изысканиях была различной. Патологоанатомы разрезали мозг перпендикулярно КСТ, в результате чего прецентральная извилина оказывалась в наиболее верхнем положении (по отношению к мозгу). При выполнении МРТ ориентация среза перпендикулярна скорее продольной оси тела, в результате чего прецентральная извилина редко оказывается сверху, обычно она попадает кзади. Так как КСТ - линейная структура, которая начинается от прецентральной извилины и пересекает заднее бедро внутренней капсулы, его «локализация» в мозге и в цефалической части внутренней капсулы также зависит от угла наклона поперечного среза. Вот почему патологоанатомы, которые начинают поперечные срезы мозга со средней линии прецентральной извилины, считают, что КСТ входит в заднее бедро внутренней капсулы также по средней линии. Подобным образом в исследованиях, в которых прецентральная извилина при проведении поперечных срезов мозга находится более кзади, и во внутренней капсуле КСТ находится более кзади. Последние исследования подтверждают, что независимо от угла наклона поперечных срезов КСТ пересекает заднее бедро внутренней капсулы в третьей четверти, на уровне нижнего таламуса. Кроме того, были уточнены некоторые особенности соматотопической организации КСТ - волокна к мышцам рук по отношению к волокнам мышц ног ориентированы антеролатерально, а не антеромедиально, как это считалось ранее [52]. Помимо академического интереса знание точной локализации и внутренней организации КСТ при прохождении через лучистый венец и заднее бедро внутренней капсулы имеет крайне важное практическое значение. К примеру, оно может быть использовано при планировании нейрохирургических операций у пациентов с болезнью Паркинсона, с кровоизлияниями, и особенно для пре- и даже интраоперативной локализации КСТ у больных с опухолями головного мозга [35, 55-57]. Случайное пересечение КСТ может иметь крайне негативные последствия, в то время как трактография позволяет точно описать взаимосвязь КСТ с опухолью и улучшить планирование операции. Заключение Трактография становится доступной методикой магнитно-резонансного исследования головного мозга. Она удлиняет проведение процедуры МРТ всего на 7-9 минут. При наличии специального программного обеспечения обработка ДВ изображений занимает менее 5 минут. Методика реконструкции трактограмм необременительна для неврологов или специалистов по лучевой диагностике. Таким образом, трактографию можно использовать в рутинной клинической практике. Правда, следует указать, что она имеет определенные ограничения: • ДВ МРТ хорошо отображает анатомическую структуру проводящих путей, но не дает информации о процессах, происходящих в синапсах. Пространственное разрешение 1,5-тесловыхтомографов составляет приблизительно 1-2 мм. В воксел такого объема помещается множество синаптических соединений, которые не могут быть видны, поэтому такие крупные проводящие пути, как кортикоспинальный тракт или мозолистое тело, хорошо видны при помощи трактографии, в то время как визуализация, например, мозжечково-таламо-кортикальных соединений затруднена; • трактография определяет пространственную ориентацию и связи проводящих путей, но подвержена ошибкам, связанным с эффектом частичного объемного усреднения, шумом, нет корректным выделением области интереса; • техника проведения трактографии зависит от исследователя - его знания анатомии проводящих путей и умения соотнести их с МР-изображениями; • результаты трактографии определяются исследователем визуально, поэтому они весьма субъективны. Эта методика нуждается в дальнейшей стандартизации. Кроме того, это в большей степени экспериментальный прием, требующий дальнейшей активной разработки; • интерпретация трактограмм осложнена отсутствием «золотого стандарта», поскольку это единственный метод визуализации проводящих путей in vivo, в то время как при гистологическом исследовании in vitro мозг подвергается деформации из-за выполнения секции, охлаждения, дегидратации, фиксации [8]. Область применения трактографии постоянно расширяется. Исследователи и фирмы-производители магнитно-резонансного оборудования предлагают новое и усовершенствованное программное обеспечение для реконструкции трактограмм. Таким образом, на сегодняшний день ожидается внедрение в рутинную клиническую практику трактографии, что может быть чрезвычайно полезно в специализированных неврологических клиниках, изучающих структуру белого вещества головного мозга и влияние на нее различных патологических состояний. Необходимо проведение дальнейших исследований, уточняющих области клинического применения МРТ. Список литературы 1. Basser P.J., Mattiello J., Le Bihan D. MR diffusion tensor spectroscopy and imaging./. Biophys. 1994; 66: 259-267. 2. Le Bihan D., Breton E., Lallemand D. et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. Radiology. 1986; 161:401-407. 3. Lee S.K., Kim D.I., Kim J. et al. Diffusion-tensor MR imaging and fiber tractography: a new method of describing aberrant fiber connections in developmental CNS anomalies. RadioGraphics. 2005; 25: 53-68. 4. Moseley M.E., Cohen Y, Kucharczyk J. et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 1990; 176: 439-445. 5. Stieltjes В., Kaufmann WE., van Zijl EC. et al. Diffusion tensor imaging and axonal tracking in the human brainstem. Neuroimage. 2001; 14: 723-735. 6. Beaulieu C. The basis of anisotropic water diffusion in the nervous system - a technical review. NMR Biomed.2002; 15: 435-455. 7. Sun S.W, Song S.K., Harms M.P. et al. Detection of age-dependent brain injury in a mouse model of brain amyloidosis associated with Alzheimer's disease using magnetic resonance diffusion tensor imaging. Exp. Neurol. 2005; 191:77-85. 8. Basser P.J., Pajevic S., Pierpaoli C. et al. In vivo fiber tractography using DT-MRI data. Magn. Reson. Med.2000; 44: 625-632. 9. Delmarcelle Т., Hesselink L. Visualizing second-order tensor fields with hyperstream lines. IEEE Computer Graphics and Applications. 1993; 13: 25-33. 10. Xue R., van Zijl P.C.M., Crain B.J. et al. In vivo three-dimensional reconstruction of rat brain axonal projections by diffusion tensor imaging. Magn. Reson. Med.1999; 42: 1123-1127. 11. Zhang S., Demiralp C, Laidlaw D.H. Visualizing diffusion tensor MR images using streamtubes and streamsurfaces. IEEE Transactions on Visualization and Computer Graphics. 2003; 9: 454-462. 12. Wakana S., Jiang H., Nagae-Poetscher L.M. et al. Fiber tract based atlas of human white matter anatomy. Radiology. 2004; 230: 77-87. 13. Le Bihan D., Mangin J.E, Poupon C. et al. Diffusion tensor imaging: concepts and applications. J. Magn.Reson. Imaging. 2001; 13: 534-546. 14. Mori S., Crain B.J., Chaco VP, van Zijl PC. Three-dimensional tracking of axonal projections in the brain by magnetic resonance imaging. Ann. Neurol. 1999; 45:265-269. 15. Ulug A.M., Moore D.E, Bojko A.S., Zimmerman R.D.Clinical use of diffusion-tensor imaging for diseases causing neuronal and axonal damage. Am. J. Neuroradiol. 1999; 20: 1044-1048. 16. Tievsky A.L., Ptak Т., Farkas J. Investigation of apparent diffusion coefficient and diffusion tensor anisotrophy in acute and chronic multiple sclerosis lesions.Am. J. Neuroradiol. 1999; 20: 1491-1499. 17 Werring D.J., Clark C.A., Barker GJ. et al. Diffusion tensor imaging of lesions and normal-appearing white matter in multiple sclerosis. Neurology. 1999; 52: 1626-1632. 18. Inglese M., Salvi E, Iannucci G. et al. Magnetization transfer and diffusion tensor MR imaging of acute disseminated encephalomyelitis. Am. J. Neuroradiol. 2002;23:267-272. 19. Eriksson S.H., Rugg-Gunn F.J., Symms M.R. et al. Diffusion tensor imaging in patients with epilepsy and malformations of cortical development. Brain. 2001;124:617-626. 20. Sotak C.H.The role of diffusion tensor imaging in the evaluation of ischemic brain injury - a review. NMR Biomed. 2002; 15: 561-569. 21. Kier E.L., Staib L.H., Davis L.M., Bronen R.A. Anatomic dissection tractography: a new method for precise MR localization of white matter tracts. Am. J. Neuroradiol. 2004; 25: 670-676. 22. Catani M., Jones D.K., Donato R., Flytche D.H. Occi-pito-temporal connections in the human brain. Brain. 2003; 126:2093-2107. 23. Croxson P.L., Johanssen-Berg H., Behrens T.E.J. et al.Quantative investigation of connections of the prefrontal cortex in the human and macaque using probabilistic diffusion tractography. J. Neuroscience. 2005;25:8854-8866. 24. Kim D-S., Kima M., Rohena I. et al. In vivo mapping of functional domains and axonal connectivity in cat visual cortex using magnetic resonance imaging. MRIJournal. 2003; 21: 1131-1140. 25. Volpe J.J. Neurology of the newborn. WB. Saunders Company. 1995. 26. Foong J., Maier M., Clark C.A. et al. Neuropathological abnormalities of the corpus callosum in schizophrenia: a diffusion tensor imaging study. / Neurol. Neurosurg. Psychiatry. 2000; 68: 242-244. 27 Horsfield M.A., Jones D.K. Applications of diffusion-weighted and diffusion tensor MRI to white matter diseases - a review. NMR in Biomedicine. 2002; 15: 570-577. 28. Ito R., Melhem E.R., Mori S. et al. Diffusion tensor brain MR imaging in X-linked cerebral adrenoleuko-dystrophy. Neurology. 2001; 56: 544-547 29. Kubicki M., Westin C-E, Maier S.E. et al. Diffusion tensor imaging and ist application to neuropsychiatric disorders. Harvard Rev. of Psychiatry. 2002; 10: 234-236. 30. Lim K.O., Helpern J.A. Neuropsychiatric applications of DTI - a review. NMR in Biomedicine. 2002; 15: 587-593. 31. Pomara N., Crandall D.T., Choi S.J. et al. White matter abnormalities in HIV-1 infection: diffusion tensor imaging study. Psychiatry Res. 2001; 106: 15-24. 32. Rose S.E., Chen E, Chalk J.B. et al. Loss of connectivity in Alzheimer's disease: an evaluation of white matter tract integrity with color-coded MR diffusion tensor imaging./ Neurol. Neurosurg. Psychiatry. 2000; 69: 528-530. 33. Schwartz R.B., Mulkern R.V, Gudbjartsson H., Jolesz F. Diffusion-weighted MR imaging in hypertensive encephalopathy: clues to pathogenesis. AJNR. 1998; 19: 859-862. 34. Sundgren PC, Dong Q., Gomez-Hassan D. et al. Diffusion tensor imaging of the brain: review of clinical applications. Neuroradiology. 2004; 46: 339-350. 35. Wieshmann U.C., Symms M.R., Parker GJ. et al. Diffusion tensor imaging demonstrates deviation of fibres in normal appearing white matter adjacent to a brain tumor.J. Neurol. Neurosurg. Psychiatry. 2000; 68: 501-503. 36. Mori S., Frederiksen K., van Zijl PC. et al. Brain white matter anatomy of tumor patients evaluated with diffusion tensor imaging. Ann. Neurol. 2002; 51: 337-338. 37. Gossl C, Fahrmeir L., Putz B. et al. Fiber tracking from DTI using linear state space models: detectability of the pyramidal tract. Neuroimage. 2002; 16: 378-388. 38. Witwer B.P., Moftakhar R., Hasan K.M. et al. Diffusion-tensor imaging of white matter tracts in patients with cerebral neoplasm./ Neurosurg. 2002; 97: 568-575. 39. Zhang S., Bastin M.E., Laidlaw D.H. et al. Visualization and analysis of white matter structural asymmetry in diffusion tensor MR imaging data. MR in Medicine.2004; 51: 140-147. 40. Simon J.H., Zhang S., Laidlaw D.H. et al. Identification of fibers at risk for degeneration by diffusion tractography in patiens at high risk for MS after a clinically isolated syndrome./ Magn. Reson. Imaging. 2006; 24: 983-988. 41. Paul R.H., Cohen R., Stern R. Neurocognitive manifestations of HIV CNS Spectrums. 2003; 7: 860-866. 42. Paul R.H., Cohen R., Navia B. et al. Relationships between cognition and structural neuroimaging findings in adults with human immunodeficiency virus type-1.Neurosc. Biobehav. Rev. 2002; 26: 353-359. 43. Filippi C.G., Ulug A.M., Ryan E. et al. Diffusion tensor imaging if patients with HIV and normal-appearing white matter on MR images of the brain. Am. J. Neurorad. 2001; 22: 277-283. 44. Ragin А.В., Storey P., Cohen B.A. et al. Whole brain diffusion tensor imaging in HIV-associated cognitive impairment. Am. J. Neurorad. 2004; 25: 195-200. 45. Charcot J.M. Lecture on the localization of cerebral and spinal diseases. Hodden M.A., trans-ed. London, England: New Sydenham Society. 1883; 186-189. 46. Dejerine J. Anatomie des centres nerveaux. Paris,France: Ruef. 1901; 720. 47. Foerster O. Motorische felder und bahnen. In: Bumke,Foerster O. eds. Handbuch der neurologic Berlin.Germany: Springer. 1936; 6: 357. 48. Bertrand G., Blundell J., Musella R. Electrical exploration of the internal capsule and neighboring structures during stereotactic procedures. J. Neurosurg.1965; 22: 333-343. 49. Englander R.N., Netsky M.G., Adelman L.S. Location of the human pyramidal tract in the internal capsule:anatomical evidence. Neurology. 1975; 25: 823-826. 50. Guiot G., Sachs M., Herzog E. et al. Stimulation electrique et lesions chirurgigicales de la capsule interne.Neurochirurgie. 1959; 5 : 17-42. 51. Hanaway J., Young R.R. Localization of the pyramidal tract in the internal capsule of man. J. Neurol. Sci. 1977;34: 63-70. 52. Holodny A.I., Gor D.M., Watts R, et al. Diffusion-tensor MR tractography of somatotopic organization of corticospinal tracts in the internal capsule: initial anatomic results in contradistinction to prior reports. Radiology. 2005; 234: 649-653. 53. Kretschmann H.J. Localization of the corticospinal fibers in the internal capsule in man./. Anat. 1988; 160:219-225. 54. Ross E.D. Localization of pyramidal tract in the internal capsule by whole brain dissection. Neurology. 1980; 30: 59-64. 55. Holodny A.I., Ollenschleger M.D., Liu W.C. Diffusion imaging in brain tumors. Neuroimaging. Clin. N. Am.2002; 12: 107-124. 56. Holodny A.I., Ollenschleger M.D., Liu W.C. et al. Iden tification of the corticospinal tracts using BOLD and diffusion fMRI in patients with brain tumors. AJNR.2001; 22: 83-88. 57. Holodny A.I., Schwartz Т.Н., Ollenschleger M.D. et al.Involvement of the corticospinal tract by tumor: diffusion MR tractography with intra-operative correlation. J. Neurosurg. 2001; 95: 1082. 58. BarrickT.R., Clark C.A. Singularities in diffusion tensor fields and their relevance in white matter fiber tractography. Neurolmage. 2004; 22: 481-491. 59. Parmar H., Golay X., Lee K.E. et al. Early experiences with diffusion tensor imaging and magnetic resonance tractography in stroke patients./ Singapore Med. 2006; 47:198-203. 60. Melhem E.R., Mori S., Mukundan G. et al. Diffusion tensor MR imaging of the brain and white matter tractography. AJR. 2002; 178: 3-16. | |
|
| |
| Total comments: 2 | |||||||
| |||||||